- Forfatter Rachel Wainwright wainwright@abchealthonline.com.
- Public 2023-12-15 07:40.
- Sist endret 2025-11-02 20:14.
Interferon beta-1b
Interferon beta-1b: bruksanvisning og anmeldelser
- 1. Slipp form og sammensetning
- 2. Farmakologiske egenskaper
- 3. Indikasjoner for bruk
- 4. Kontraindikasjoner
- 5. Metode for påføring og dosering
- 6. Bivirkninger
- 7. Overdosering
- 8. Spesielle instruksjoner
- 9. Påføring under graviditet og amming
- 10. Bruk i barndommen
- 11. Ved nedsatt nyrefunksjon
- 12. For brudd på leverfunksjonen
- 13. Legemiddelinteraksjoner
- 14. Analoger
- 15. Vilkår og betingelser for lagring
- 16. Vilkår for utlevering fra apotek
- 17. Anmeldelser
- 18. Pris på apotek
Latinsk navn: Interferon beta-1b
ATX-kode: L03AB08
Aktiv ingrediens: interferon beta-1b (Interferon beta-1b)
Produsent: Biocad, CJSC (Russland)
Beskrivelse og bildeoppdatering: 07.10.2019

Interferon beta-1b er et medikament med antivirale, antiproliferative, immunmodulerende effekter, brukt til å behandle multippel sklerose.
Slipp form og komposisjon
Doseringsform - løsning for subkutan administrering: gjennomsiktig, gulaktig eller fargeløs (dose 8 millioner IE / 1 ml: i en pappeske 1-3 eller 6 blisterpakninger som inneholder 5 hetteglass med 1 ml hver; en ekstra pakke med hetteglass kan fylles med 5, 10, 15 eller 30 engangssprøyter med nål og medisinske injeksjonsnåler med / uten 10, 20, 30 og 60 spritservietter; dosering 8 millioner IE / 0,5 ml: i en pappeske 1, 5 eller 15 blisterpakninger som inneholder tre-komponent steril sprøyte på 0,5 ml, og instruksjoner for bruk av Interferon beta-1b).
Sammensetning av 1 ml oppløsning:
- aktivt stoff: humant rekombinant interferon β-1b - 8 eller 16 millioner IE (internasjonale enheter);
- hjelpekomponenter: polysorbat-80 - 0,04 mg; natriumacetattrihydrat - 0,408 mg; dekstran (gjennomsnittlig molekylvekt 50-70 tusen) - 15 mg; dinatriumedetat-dihydrat - 0,055 5 mg; mannitol - 50 mg; iseddik - opp til pH 4; vann til injeksjon - opptil 1 ml.
Farmakologiske egenskaper
Farmakodynamikk
Den aktive substansen i Interferon beta-1b - rekombinant interferon β-1b (IFN-β-1b) - er isolert fra Escherichia coli-celler. Genet fra humant interferon beta blir introdusert i genomet til disse cellene, som koder for aminosyren i serien i 17. posisjon. IFN-β-1b er et ikke-glykosylert protein med 165 aminosyrer og en molekylvekt på 18 500 Dalton.
Ved sin struktur er interferoner proteiner og tilhører cytokinfamilien. Molekylvekten deres varierer fra 15.000 til 21.000 Dalton. Interferoner av de tre hovedklassene (alfa, beta og gamma) har en lignende virkningsmekanisme, med forskjellige biologiske effekter bemerket. Aktiviteten til interferoner er artsspesifikk; derfor kan deres effekter bare studeres hos mennesker eller i menneskelige cellekulturer.
IFN-β-1b har immunmodulerende og antiviral aktivitet. I MS (multippel sklerose) er virkningsmekanismen ikke fullstendig forstått. Imidlertid er det fastslått at den biologiske effekten av IFN-β-1b er basert på interaksjonen med spesifikke reseptorer som finnes på overflaten av humane celler. Når IFN-β-1b binder seg til disse reseptorene, induseres ekspresjon av en rekke stoffer som antas å være formidlere av de biologiske effektene av IFN-β-1b. Noen av disse stoffene påvises i serum- og blodcellefraksjoner fra pasienter behandlet med IFN-β-1b. Dens bruk hjelper til med å redusere interferon-gamma-reseptorens bindingskapasitet, og øker dermed nedbrytning og internalisering. IFN-β-1b potenserer også suppressoraktiviteten til perifere mononukleære celler.
Studier med sikte på å studere effekten av IFN-β-1b på funksjonen til det kardiovaskulære systemet, endokrine og luftveiene er ikke utført.
Ifølge resultatene av en kontrollert klinisk studie viste IFN-β-1b-behandling hos pasienter med tilbakevendende MS som er i stand til å gå uavhengig (EDSS fra 0 til 5,5) en 30% reduksjon i frekvensen av forverringer, samt en reduksjon i alvorlighetsgraden av forverringer og antall sykehusinnleggelser på grunn av underliggende sykdom.
I fremtiden var det en økning i intervallet mellom forverringer og en tendens til å bremse sykdomsutviklingen.
I to kontrollerte kliniske studier av pasienter med sekundær progressiv MS som er i stand til å gå uavhengig (EDSS 3 til 6.5), hvis viktigste endepunkt var tid til å bekrefte progresjon, var det motstridende data.
En studie fant en statistisk signifikant nedgang i utviklingshastigheten for funksjonshemming og en økning i tidsintervallet til det øyeblikket hvor evnen til å bevege seg uavhengig, dvs. ved hjelp av rullestol eller EDSS 7.0, ble funnet blant pasienter som tok IFN-β-1b. Den terapeutiske effekten av bruken av Interferon beta-1b vedvarte gjennom den påfølgende observasjonsperioden, uavhengig av hyppigheten av forverring.
Den andre studien viste ingen nedgang i progresjonstakten til sekundær progressiv MS. Imidlertid hadde pasientene som inngikk i denne studien mindre sykdomsaktivitet enn pasienter i andre studier. En retrospektiv metaanalyse av data fra begge studiene viste en statistisk signifikant effekt.
I følge resultatene av en retrospektiv analyse ble en mer uttalt effekt på frekvensen av MS-progresjon observert i pasientgruppen med høy sykdomsaktivitet før behandlingsstart. Etter å ha analysert tilgjengelige data, kan det konkluderes med at vurderingen av hyppigheten av tilbakefall og den raske utviklingen av EDSS kan lette identifiseringen av pasienter med et aktivt sykdomsforløp. Også i disse studiene ble det registrert en reduksjon i frekvensen av forverringer (30%). Effekten av IFN-β-1b på varigheten av forverringsperioden er ikke vist.
Hos pasienter med CIS (Clinically Isolated Syndrome) ble det utført en kontrollert klinisk studie av IFN-β-1b, noe som antydet tilstedeværelsen av en enkelt klinisk episode av demyelinisering og / eller minst to lesjoner som klinisk ikke manifesterte seg på T2-vektede MR-bilder (magnetisk resonansavbildning).), som ikke er nok til å diagnostisere klinisk pålitelig MS. Det er fastslått at CIS sannsynligvis vil føre til utvikling av MS i fremtiden. Studien inkluderte pasienter med en eller to eller flere kliniske foci på MR. I dette tilfellet bør alle alternative sykdommer som kan være den mest sannsynlige årsaken til de eksisterende symptomene, unntatt MS, ekskluderes.
Studien besto av to faser: en placebokontrollert fase og en oppfølgingsfase. Den første fasen varte i to år eller til overgangen til pasienten til KDRS (klinisk signifikant multippel sklerose). Deretter ble han overført til oppfølgingsfasen med IFN-β-1b-terapi. For å vurdere den tidlige / forsinkede effekten av forskrivning av legemidlet ble pasientgruppene som først ble randomisert til IFN-β-1b og placebo sammenlignet (henholdsvis gruppe med umiddelbar og forsinket behandling).
I den placebokontrollerte fasen av studien ble det statistisk pålitelig bekreftet at IFN-β-1b forhindrer overgangen av CIS til EDMS. I pasientgruppen som fikk IFN-β-1b, var det en forsinkelse i transformasjon til signifikant MS i henhold til McDonalds kriterier.
Avhengig av basislinjefaktorer demonstrerte undergruppeanalyser effekten av IFN-β-1b for å forhindre transformasjon til MDRS i alle undergrupper. Sannsynligheten for transformasjon til KDRS i to år var høyere i gruppen pasienter med monofokalt CIS med foci på T2-vektede bilder i mengden 9 eller mer, eller med foci som akkumulerer kontrast, ifølge MR-data i begynnelsen av studien. I gruppen pasienter med multifokale kliniske manifestasjoner var effekten av IFN-β-1b ikke avhengig av MR-parametere ved baseline. Dette er bevis på at pasienter i denne gruppen har høy risiko for transformasjon av CIS til CDRS.
Det er foreløpig ingen generelt akseptert definisjon av høy risiko, men pasienter med monofokalt CIS (med klinisk manifestasjon av en lesjon i sentralnervesystemet) og med minst 9 lesjoner på MR i T2-modus og / eller akkumulerende kontrastmiddel. Pasienter med multifokalt CIS, med kliniske manifestasjoner av en eller flere foci i sentralnervesystemet, anses å ha høy risiko for å utvikle KDRS, uavhengig av antall foci på MR. I alle fall tas beslutningen om å foreskrive IFN-β-1b på bakgrunn av konklusjonen om at pasienten har høy risiko for å utvikle CDRS.
IFN-β-1b-behandling tolereres generelt godt av pasienter, noe som fremgår av den lave frafallshastigheten (93% fullførte studien).
For å forbedre toleransen for behandlingen ble dosen av Interferon beta-1b titrert, i begynnelsen av behandlingen ble ikke-steroide antiinflammatoriske legemidler brukt. Også de fleste pasientene brukte en autoinjektor gjennom hele studien.
Deretter, etter 3 og 5 års oppfølging, forble IFN-β-1b svært effektiv i sin evne til å forhindre utvikling av EDMS, til tross for at flertallet av pasientene som fikk placebo begynte behandling med IFN-β-1b to år etter studiestart. Bekreftet progresjon av EDSS var lavere i den umiddelbare gruppen. I de fleste tilfeller var det ingen progresjon av uførhet i begge grupper i løpet av en femårsperiode. Det er ingen overbevisende bevis som støtter dette resultatet med umiddelbar IFN-β-1b. Effekten av øyeblikkelig behandling med IFN-β-1b på pasientens livskvalitet er ikke vist.
Effekten av IFN-β-1b ble presentert i alle kliniske studier for evnen til å redusere aktiviteten til remitterende, sekundær progressiv MS og CIS, vurdert av MR. Foreløpig er ikke forholdet mellom den kliniske aktiviteten til MS og sykdomsaktiviteten ved MR-parametere fullstendig etablert.
Farmakokinetikk
Etter subkutan administrering av den anbefalte dosen (8 millioner IE) blir IFN-β-1b påvist i lave serumkonsentrasjoner, eller stoffet oppdages ikke i det hele tatt. Derfor er det ingen data om farmakokinetiske prosesser av legemidlet hos MS-pasienter som mottar IFN-β-1b i anbefalt dose. De maksimale plasmanivåene av legemidlet etter administrering av 16 millioner IE 1-8 timer etter injeksjon er omtrent 40 IE / ml.
Klaringen av IFN-β-1b og dens T 1/2 (halveringstid) fra serum, ifølge resultatene fra en rekke kliniske studier, er henholdsvis 30 ml / min / kg og 5 timer. Den absolutte biotilgjengeligheten er omtrent 50%.
Med introduksjonen av IFN-β-1b annenhver dag forekommer ikke en økning i plasmanivået i blodet; i løpet av behandlingen endres farmakokinetikken sannsynligvis ikke.
Ved administrering subkutant annenhver dag, IFN-β-1b 0,25, økte nivåene av biologiske responsmarkører (neopterin, immunsuppressivt cytokin interleukin-10 og β2-mikroglobulin) signifikant sammenlignet med baselineverdiene 6-12 timer etter første dose. De nådde en topp på 40-124 timer og forble forstørret i løpet av studietiden på syv dager (168 timer). Forholdet mellom plasmanivået til IFN-β-1b eller nivået av markører indusert av det og virkningsmekanismen til IFN-β-1b i MS er ikke etablert.
Indikasjoner for bruk
- CIS (tilstedeværelsen av en enkelt klinisk episode av demyelinisering, som antyder MS i tilfeller der alternative diagnoser er ekskludert) med en tilstrekkelig uttalt inflammatorisk prosess for administrering av intravenøse kortikosteroider: Interferon beta-1b er foreskrevet for å bremse overgangen til EDRS hos pasienter med høy risiko for utvikling;
- remitterende MS: interferon beta-1b brukes til å redusere alvorlighetsgraden og hyppigheten av forverring av sykdommen hos pasienter som er i stand til å gå uten hjelp, i tilfeller der det har vært historie med minst to forverringer av sykdommen de siste 2 årene, etterfulgt av fullstendig / delvis gjenoppretting av nevrologisk underskudd;
- Sekundær progressiv MS i et aktivt forløp, preget av forverringer eller alvorlig forverring av nevrologiske funksjoner de siste to årene: terapi utføres for å redusere alvorlighetsgraden og hyppigheten av kliniske forverringer av sykdommen, samt for å redusere hastigheten på sykdomsprogresjonen.
Kontraindikasjoner
Absolutt:
- leversykdom i dekompensasjonsstadiet;
- epilepsi (i fravær av tilstrekkelig kontroll av tilstanden);
- tynget historie med alvorlig depressiv sykdom og / eller selvmordstanker;
- graviditet og amming;
- alder opp til 18 år;
- individuell intoleranse mot komponentene i stoffet.
Relativt (Interferon beta-1b er foreskrevet under medisinsk tilsyn):
- en tynget historie med depresjon eller anfall;
- alvorlig nyresvikt
- hjertesvikt stadium III - IV i henhold til NYHA klassifisering;
- kardiomyopati;
- dysfunksjon i benmargen;
- trombocytopeni;
- anemi;
- kombinert bruk med krampestillende midler.
Interferon beta-1b, bruksanvisning: metode og dosering
Interferon beta-1b-behandling bør igangsettes under tilsyn av en lege med erfaring i MS-behandling. Legemidlet administreres subkutant.
Den anbefalte voksendosen med IFN-β-1b er 8 millioner IE annenhver dag.
Dosetitrering anbefales vanligvis i begynnelsen av behandlingen. Behandlingen begynner med 2 millioner IE IFN-β-1b annenhver dag, og øker dosen gradvis til 8 millioner IE, også administrert annenhver dag (med 2 millioner IE hver 3. injeksjon). Titreringsperioden, avhengig av stoffets individuelle toleranse, kan variere.
Anbefalt kurslengde er ikke etablert på dette tidspunktet. Det er resultater fra kliniske studier der varigheten av bruken av interferon beta-1b hos pasienter med sekundær progressiv og remitterende MS nådde henholdsvis 3 og 5 år. I pasientgruppen med tilbakevendende MS ble det registrert høy effekt i løpet av de første to årene. Ytterligere observasjon i løpet av 3 år avslørte bevaring av effektindikatorer i hele perioden med narkotikabruk. Hos pasienter med CIS var det en betydelig forsinkelse i transformasjonen til signifikant MS over en periode lenger enn fem år.
Bruk av IFN-β-1b hos pasienter med tilbakefall-remitterende multippel sklerose (RRMS) som har hatt færre enn to forverringer de siste to årene, eller pasienter med sekundær progressiv MS som ikke har utviklet seg de siste to årene er ikke indikert …
Pasienter som ikke har stabilisert sykdomsforløpet (for eksempel med vedvarende progresjon av sykdommen på EDSS-skalaen i seks måneder, eller hvis det er behov for 3 eller flere behandlingsforløp med glukokortikosteroider eller kortikotropin) innen 12 måneder, avbrytes bruken av Interferon beta-1b.
Det anbefales å injisere om kvelden før sengetid. Før prosedyren må du vaske hendene grundig med såpe og vann.
En blisterstripe med fylt sprøyte / flaske fra en pappeske må tas ut av kjøleskapet og oppbevares ved romtemperatur i noen tid. Dette vil tillate at preparatets temperatur tilsvarer omgivelsestemperaturen. Hvis det oppstår kondens på overflaten av sprøyten / hetteglasset, vent noen minutter til den fordamper.
Før løsningen injiseres, bør den inspiseres for misfarging eller tilstedeværelsen av suspenderte partikler. Du må også sørge for at sprøyten / hetteglasset er integrert. Hvis det oppstår skum (muligens ved å riste eller riste sprøyten / flasken), må du vente til det legger seg.
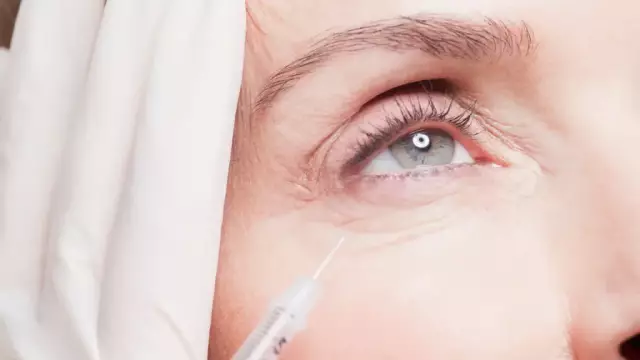
IFN-β-1b skal injiseres i det subkutane fettvevet; til injeksjon, bruk steder med løs fiber borte fra områder med hudstrekk, plasseringen av blodkar, ledd og nerver. Interferon beta-1b kan injiseres i de fremre lårene (unntatt kneet og lysken), magen (unntatt midtlinjen og navlestrengen), den ytre overflaten på skuldrene og den øvre ytre kvadranten på baken.
Det anbefales ikke å bruke ømme flekker, rødmalte, misfargede områder av huden eller områder med knuter og klumper for injeksjoner. For en injeksjon er det nødvendig å velge et nytt sted hver gang, noe som vil redusere smerte og ubehag på hudområdet ved injeksjonsstedet. Inden for et bestemt område bør injeksjonspunktene endres kontinuerlig.
Mengden Interferon beta-1b-oppløsning som må administreres bestemmes av dosen som legen anbefaler. Ikke oppbevar legemidlet som er igjen i sprøyten / hetteglasset etter injeksjon for gjenbruk.
Før hver dose administreres, er det nødvendig å desinfisere hudområdet der Interferon beta-1b vil bli injisert. Etter at huden er tørr, må du brette den forsiktig med tommelen og pekefingeren. Sprøyten er plassert vinkelrett på injeksjonsstedet. Anbefalt dybde for innsetting av nål fra hudoverflaten er 6 mm. Dybde kan variere avhengig av kroppstype og tykkelsen på det subkutane fettet.
Hvis en dose blir savnet, må den administreres så snart som mulig. Intervallet til neste injeksjon av Interferon beta-1b bør være 48 timer. Innføringen av en dobbel dose av stoffet er uakseptabelt.
Du bør ikke avbryte behandlingsforløpet uten medisinsk råd.
Bivirkninger
Bivirkninger blir ofte observert i de innledende stadiene av bruken av Interferon beta-1b, men ved videre bruk av stoffet reduseres intensiteten og frekvensen.
Oftest ble utviklingen av et influensalignende symptomkompleks (i form av feber, frysninger, svette, utilpashed, hodepine, leddsmerter eller muskelsmerter) og reaksjoner på injeksjonsstedet bemerket, noe som i stor grad skyldes de farmakologiske egenskapene til IFN-β-1b.
De vanligste reaksjonene på injeksjonsstedet: ødem, rødhet, misfarging, nekrose, betennelse, overfølsomhet, smerte, uspesifikke reaksjoner.
For å forbedre toleransen anbefales det å starte behandlingen med dosetitrering. Influensalignende syndrom kan korrigeres med ikke-steroide antiinflammatoriske legemidler. Forekomsten av reaksjoner på injeksjonsstedet kan reduseres ved å bruke en autoinjektor.
Erfaring med IFN-β-1b i MS er begrenset, så bivirkninger, som utvikler seg i svært sjeldne tilfeller, er kanskje ikke identifisert ennå.
Bivirkninger som forekommer med en frekvens på> 10% sammenlignet med frekvensen av tilsvarende hendelse med placebo, samt signifikante bivirkninger assosiert med terapi <10% (CIS; sekundær progressiv MS i henhold til europeiske / nordamerikanske studier; tilbakefall MS)
- lymfesystem og blod: leukopeni (11%; 13% / 13%; 16%); lymfopeni (79%; 53% / 88%; 82%); nøytropeni (11%; 18% / 4%; 18%); lymfadenopati (1%; 3% / 11%; 14%);
- smittsomme lesjoner: infeksjoner (6%; 13% / 11%; 14%); abscess (0%; 4% / 4%; 1%);
- psyke: angst (3%; 6% / 10%; 15%); depresjon (10%; 24% / 44%; 25%);
- metabolisme: hypoglykemi (3%; 27% / 5%; 15%);
- sanseorgan: konjunktivitt (1%; 2% / 6%; 12%); øreplager (0%; <1% / 6%; 16%); synshemming (3%; 11% / 11% 7%);
- nervesystemet: parestesier (16%; 35% / 40%; 19%); hodepine (27%; 47% / 55%; 84%); migrene (2%; 4% / 5%; 12%); svimmelhet (3%; 14% / 28%; 35%); søvnløshet (8%; 12% / 26%; 31%;);
- luftveier: hoste (2%; 5% / 11%; 31%); infeksjoner i øvre luftveier (18%; 3% / 0%; 0%); bihulebetennelse (4%; 6% / 16%; 36%); kortpustethet (0%; 3% / 8%; 8%);
- kardiovaskulært system: hjertebank (1%; 2% / 5%; 8%); vasodilatasjon (0%; 6% / 13%; 18%); arteriell hypertensjon (2%; 4% / 9%; 7%);
- reproduksjonssystem: dysmenoré (2%; <1% / 6%; 18%); brudd på menstruasjonssyklusen (1%; 9% / 10%; 17%); impotens (1%; 7% / 10%; 2%); metrorrhagia (2%; 12% / 10%; 15%);
- fordøyelsessystemet: diaré (4%; 7% / 21%; 35%); oppkast (5%; 4% / 10%; 21%); forstoppelse (1%; 12% / 22%; 24%); kvalme (3%; 13% / 32%; 48%); magesmerter (5%; 11% / 18%; 32%);
- hud og subkutant fett: utslett (11%; 20% / 26%; 27%); hudreaksjoner (1%; 4% / 19%; 6%);
- lever og galleveier: økt aspartataminotransferase (6%; 4% / 2%; 4%); økt alaninaminotransferase (18%; 14% / 4%; 19%);
- urinveiene: urinretensjon (1%; 4% / 15%; 0%); økt vannlating (1%; 6% / 12%; 3%); urininkontinens (1%; 8% / 20%; 2%); proteinuri (25%; 14% / 5%; 5%); tvingende trang (1%; 8% / 21%; 4%);
- muskel- og skjelettsystem: hypertonisitet (2%; 41% / 57%; 26%); myasthenia gravis (2%; 39% / 57%; 13%); ryggsmerter (10%; 26% / 31%; 36%); myalgi (8%; 23% / 19%; 44%); lemmer smerter (6%; 14% / 0%; 0%);
- reaksjoner på injeksjonsstedet og generelle reaksjoner: asteni (22%; 63% / 64%; 49%); ubehag (0%; 8% / 6%; 15%); frysninger (5%; 23% / 22%; 46%); svette (2%; 6% / 10%; 23%); brystsmerter (1%; 5% / 15%; 15%); perifert ødem (0%; 7% / 21%; 7%); reaksjoner på injeksjonsstedet av forskjellige typer (52%; 78% / 89%; 85%); nekrose på injeksjonsstedet (1%; 55% / 6%; 5%); influensalignende syndrom (44%; 61% / 43%; 52%); feber (13%; 40% / 29%; 59%); smerte (4%; 31% / 59%; 52%).
Mulige bivirkninger (> 10% - veldig vanlig;> 1% og 0,1% og 0,01% og <0,1% - sjelden; <0,01% - veldig sjelden):
- immunsystem: sjelden - anafylaktiske reaksjoner; veldig sjelden - syndrom med økt kapillær permeabilitet i nærvær av monoklonal gammopati;
- blod og lymfesystem: ofte - anemi; sjelden - trombocytopeni; sjelden - blødning;
- metabolisme: ofte - vektøkning / tap; sjelden - økte triglyseridnivåer i blodet; sjelden - anoreksi;
- endokrine systemet: ofte - hypotyreose; sjelden - hypertyreose, skjoldbrusk sykdom;
- kardiovaskulær system: ofte - takykardi; sjelden - hypertensjon; sjelden - senke blodtrykket, kardiomyopati;
- nervesystemet: sjelden - kramper;
- fordøyelsessystemet: sjelden - pankreatitt;
- reproduktive system: ofte - menorragi;
- muskel- og skjelettsystem: veldig ofte - artralgi;
- hepatobiliary system: ofte - økt bilirubinnivå i blodet; sjelden - hepatitt, økte nivåer av gamma-glutamyl-transpeptidase; sjelden - leversvikt, leversykdommer (inkludert hepatitt);
- hud og subkutant fett: ofte - kløe, urtikaria, alopecia; sjelden - misfarging av huden;
- luftveiene: sjelden - bronkospasme;
- psyke: ofte - forvirret bevissthet; sjelden - selvmordsforsøk, emosjonell labilitet.
Overdose
IFN-β-1b hos voksne pasienter med ondartede svulster, når det ble administrert intravenøst i doser opp til 176 millioner IE tre ganger i uken, førte ikke til utvikling av alvorlige bivirkninger.
spesielle instruksjoner
Bruk av cytokiner hos pasienter med monoklonal gammopati var i noen tilfeller ledsaget av fremveksten av et syndrom med systemisk økning i kapillærpermeabilitet i kombinasjon med sjokklignende symptomer og død.
På bakgrunn av bruken av Interferon beta-1b ble det i sjeldne tilfeller notert utvikling av pankreatitt, ofte forbundet med tilstedeværelsen av hypertriglyseridemi.
Pasienter bør informeres om at selvmordstanker og depresjon kan være en bivirkning av IFN-β-1b. Hvis de dukker opp, bør du umiddelbart oppsøke lege.
Ved forskrivning av Interferon beta-1b, bør pasienter med en historie med depressive lidelser og selvmordstanker være forsiktige (til tross for fraværet av et pålitelig bekreftet forhold mellom medisinering og utvikling av disse lidelsene). I tilfelle slike fenomener forekommer i løpet av bruken av Interferon beta-1b, bør spørsmålet om seponering av legemidlet vurderes.
På bakgrunn av skjoldbruskdysfunksjon anbefales det å kontrollere tilstanden regelmessig (kontroll av skjoldbruskstimulerende hormon, skjoldbruskkjertelhormoner), og i andre tilfeller - ifølge kliniske indikasjoner.
I tillegg til standard laboratorietester, som er foreskrevet for behandling av pasienter med MS, bør en detaljert blodprøve (inkludert bestemmelse av antall blodplater, leukocyttall) og en biokjemisk blodprøve utføres før bruk av Interferon beta-1b, og også regelmessig i løpet av behandlingsperioden. og overvåke leverfunksjonen (inkludert alaninaminotransferase, aspartataminotransferase og gammaglutamyltransferaseaktivitet).
Når det gjelder behandling av pasienter med anemi, leukopeni, trombocytopeni (individuelt eller i kombinasjon), kan det være nødvendig å gjennomføre en mer nøye overvåking av en detaljert blodprøve, inkludert bestemmelse av antall erytrocytter, blodplater, leukocytter og leukocyttformel.
I følge de utførte kliniske studiene, på bakgrunn av IFN-β-1b-terapi, observeres ofte en asymptomatisk økning i aktiviteten til levertransaminaser, som oftest er av forbigående ikke-uttrykt karakter. Som ved behandling med andre interferoner-β, med bruk av Interferon beta-1b, er alvorlig leverskade (inkludert leversvikt) sjelden. De alvorligste tilfellene ble observert hos pasienter som ble eksponert for hepatotoksiske stoffer / medikamenter, samt i noen samtidige sykdommer (inkludert alkoholisme, ondartede svulster med metastase, sepsis, alvorlige infeksjoner).
Når du bruker Interferon beta-1b, er det nødvendig med overvåking av leverfunksjonen (inkludert vurdering av det kliniske bildet). Med en økning i serumaktiviteten til transaminaser i blodet, er det nødvendig med nøye observasjon og undersøkelse. I tilfeller av en betydelig økning i disse indikatorene eller når tegn på leverskade (særlig gulsott) vises, avbrytes stoffet. Gjenopptak av terapi, under oppsyn av leverfunksjon, er mulig i fravær av kliniske tegn på nedsatt leverfunksjon eller etter at aktiviteten til leverenzymer er gjenopptatt.
Pasienter med hjertesykdom (koronar hjertesykdom, arytmier, hjertesvikt) blir foreskrevet Interferon beta-1b med forsiktighet under overvåking av funksjonen til det kardiovaskulære systemet, spesielt i begynnelsen av behandlingen.
Det er ingen bevis for en direkte kardiotoksisk effekt av IFN-β-1b, mens det influensalignende syndromet forbundet med bruk av legemidlet kan være en signifikant stressfaktor for pasienter med eksisterende signifikant kardiovaskulær sykdom. Under observasjon etter markedsføring ble det i svært sjeldne tilfeller registrert en forverring av kardiovaskulærsystemet hos pasienter med en eksisterende signifikant sykdom, som, når det gjelder utviklingstid, var forbundet med initiering av bruken av IFN-β-1b.
Det er sjeldne rapporter om utseendet av kardiomyopati på bakgrunn av bruken av Interferon beta-1b. Hvis det er mistanke om en sammenheng mellom denne tilstanden og behandlingen, avbrytes stoffet.
I løpet av behandlingsperioden med IFN-β-1b kan det oppstå alvorlige allergiske reaksjoner (sjelden, men i alvorlig og akutt form, kan forstyrrelser som bronkospasme, urtikaria og anafylaksi forekomme). Det er også informasjon om tilfeller av nekrose på injeksjonsstedet til Interferon beta-1b. Det kan dekke store områder og spre seg til muskelfascia så vel som fettvev, noe som fører til arrdannelse. Noen pasienter kan kreve fjerning av døde områder eller, i mer sjeldne tilfeller, et hudtransplantat. I dette tilfellet kan helbredelsesprosessen vare i opptil 6 måneder.
Hvis tegn på skade på hudens integritet vises (inkludert lekkasje fra injeksjonsstedet), bør pasienten oppsøke lege før han fortsetter med injeksjonen.
Hvis det oppdages flere fokaler av nekrose, avbrytes Interferon beta-1b til de skadede områdene er fullstendig leget. I nærvær av ett ikke-omfattende fokus, kan terapi fortsettes, siden det er bevis for helbredelse av det nekrotiske området ved injeksjonsstedet ved bruk av IFN-β-1b. For å redusere sannsynligheten for å utvikle denne lidelsen, anbefales det å gi injeksjoner av Interferon beta-1b med streng overholdelse av reglene for asepsis, hver gang injisere løsningen på et nytt sted og strengt subkutant.
Regelmessig, spesielt når lokale reaksjoner vises, bør riktigheten av selvinjeksjoner overvåkes.
Som ved behandling med andre legemidler med proteininnhold, er det en mulighet for dannelse av antistoffer ved bruk av Interferon beta-1b. I noen kontrollerte kliniske studier ble serumanalyse utført hver 3. måned for å oppdage dannelsen av antistoffer mot IFN-β-1b. Det ble vist at nøytraliserende antistoffer mot IFN-β-1b skjedde hos 23-41% av pasientene, noe som ble bekreftet av minst to påfølgende positive laboratorietestresultater. I påfølgende laboratoriestudier viste 43-55% av disse pasientene et stabilt fravær av antistoffer mot IFN-β-1b.
I studier som involverte pasienter med CIS, noe som tyder på MS, ble nøytraliserende aktivitet målt hver sjette måned under de respektive besøkene observert hos 16,5-25,2% av pasientene som fikk IFN-β-1b.
Utviklingen av nøytraliserende aktivitet i løpet av toårsstudien var ikke assosiert med en reduksjon i klinisk effekt.
Det er ikke bevist at tilstedeværelsen av nøytraliserende antistoffer har noen innvirkning på kliniske resultater. Forholdet mellom utseendet til bivirkninger og utviklingen av nøytraliserende aktivitet er ikke fastslått.
Beslutningen om å fortsette behandlingen eller avslutte behandlingen bør ikke baseres på statusen for nøytraliserende aktivitet, men på indikatorene for den kliniske aktiviteten til sykdommen.
Innflytelse på evnen til å kjøre biler og komplekse mekanismer
Når du kjører bil i løpet av terapiperioden, er det nødvendig å ta hensyn til sannsynligheten for bivirkninger fra sentralnervesystemet.
Påføring under graviditet og amming
Interferon beta-1b er ikke foreskrevet under graviditet / amming.
Om IFN-β-1b kan forårsake fosterskader ved behandling av gravide kvinner eller påvirke menneskelig reproduksjonsfunksjon, er ukjent.
I kontrollerte kliniske studier er det rapportert om spontane aborter hos pasienter med MS. I studier på rhesusaber var humant IFN-β-1b embryotoksisk, og før bruk ved høyere doser førte det til en økning i abortfrekvensen.
I løpet av behandlingen må kvinner i reproduktiv alder bruke adekvate prevensjonsmetoder. Når du planlegger / blir gravid, bør en kvinne ta hensyn til den potensielle risikoen. Hun anbefales å slutte å bruke Interferon beta-1b.
Det er ingen bevis som støtter eller motbeviser at IFN-β-1b utskilles i melk under amming, så den potensielle risikoen for alvorlige bivirkninger på IFN-β-1b hos ammende babyer bør vurderes.
Barndomsbruk
Det er ikke utført noen formelle kliniske og farmakokinetiske studier hos barn eller ungdom. Basert på de begrensede publiserte dataene kan det antas at sikkerhetsprofilen til IFN-β-1b i en dose på 8 millioner IE, administrert annenhver dag, i en gruppe pasienter 12-16 år, sammenlignet med behandling hos voksne, kan antas. Det er ingen data om bruk av Interferon beta-1b hos pasienter under 12 år.
På grunn av den begrensede (mangelen) på informasjon om sikkerheten ved bruk av IFN-β-1b hos pediatriske pasienter og uprøvd effekt, blir ikke Interferon beta-1b foreskrevet til pasienter under 18 år.
Med nedsatt nyrefunksjon
Forsiktighet er nødvendig ved forskrivning av Interferon beta-1b hos pasienter med alvorlig nedsatt nyrefunksjon.
For brudd på leverfunksjonen
Interferon beta-1b er kontraindisert for pasienter med leversykdom i dekompensasjonsstadiet.
Narkotikahandel
Spesielle studier rettet mot å studere interaksjonen mellom IFN-β-1b og andre legemidler / stoffer er ikke utført.
Effekten av å bruke Interferon beta-1b annenhver dag i en dose på 8 millioner IE på stoffskifte hos MS-pasienter er ukjent. ACTH (adrenokortikotropisk hormon) og glukokortikosteroider, foreskrevet i opptil 28 dager i behandlingen av forverringer, tolereres godt mot bakgrunnen av terapi med Interferon beta-1b. Bruken av IFN-β-1b i kombinasjon med andre immunmodulatorer (unntatt ACTH eller glukokortikosteroider) er ikke undersøkt.
Interferoner reduserer aktiviteten til mikrosomale leverenzymer i cytokrom P 450-systemet hos dyr og mennesker.
Ved forskrivning av IFN-β-1b i kombinasjon med medikamenter som har en smal terapeutisk indeks, hvis clearance i stor grad avhenger av aktiviteten til disse enzymene (inkludert antidepressiva, antiepileptika), må man være forsiktig. Det er også nødvendig med medisinsk tilsyn når det brukes samtidig med legemidler / stoffer som påvirker det hematopoietiske systemet.
Studier som bestemmer kompatibiliteten mellom IFN-β-1b og medikamenter med antiepileptisk virkning er ikke utført.
Analoger
Interferon beta-1b-analoger er Betaferon, Extavia, Ronbetal, Infibeta.
Vilkår for lagring
Oppbevares ved 2-8 ° C. Oppbevares utilgjengelig for barn.
Holdbarhet er 2 år.
Innenfor spesifisert holdbarhet er det lov å oppbevare et uåpnet hetteglass / sprøyte ved en temperatur som ikke overstiger 25 ° C i en måned.
Vilkår for utlevering fra apotek
Reseptert på resept.
Anmeldelser av Interferon beta-1b
Anmeldelser av Interferon beta-1b fra pasienter indikerer effektiviteten. Imidlertid peker mange på utviklingen av uttalte bivirkninger, leger og pasienter bemerker at det blant analoger har den verste toleransen. Den største fordelen er at stoffet kan fås gratis etter bekreftelse av diagnosen MS.
Pris for Interferon beta-1b på apotek
Den omtrentlige prisen for Interferon beta-1b (5 sprøyter på 8 millioner IE / 0,5 ml) er 7.000-15.950 rubler.

Anna Kozlova Medisinsk journalist Om forfatteren
Utdanning: Rostov State Medical University, spesialitet "Allmennmedisin".
Informasjon om stoffet er generalisert, kun gitt for informasjonsformål og erstatter ikke de offisielle instruksjonene. Selvmedisinering er helsefarlig!