- Forfatter Rachel Wainwright [email protected].
- Public 2023-12-15 07:40.
- Sist endret 2025-11-02 20:14.
Tafinlar
Tafinlar: bruksanvisning og anmeldelser
- 1. Slipp form og sammensetning
- 2. Farmakologiske egenskaper
- 3. Indikasjoner for bruk
- 4. Kontraindikasjoner
- 5. Metode for påføring og dosering
- 6. Bivirkninger
- 7. Overdosering
- 8. Spesielle instruksjoner
- 9. Påføring under graviditet og amming
- 10. Bruk i barndommen
- 11. Ved nedsatt nyrefunksjon
- 12. For brudd på leverfunksjonen
- 13. Bruk hos eldre
- 14. Legemiddelinteraksjoner
- 15. Analoger
- 16. Vilkår og betingelser for lagring
- 17. Vilkår for utlevering fra apotek
- 18. Anmeldelser
- 19. Pris på apotek
Latinsk navn: Tafinlar
ATX-kode: L01XE23
Aktiv ingrediens: dabrafenib (Dabrafenib)
Produsent: Glaxo Operations UK Limited (Storbritannia); Glaxo Wellcome S. A. (Glaxo Wellcome SA) (Spania); OOO Skopinsky Pharmaceutical Plant (OOO SKOPINFARM) (Russland); GlaxoSmithKline Inc (Canada); GlaxoSmithKline Trading, CJSC (Russland)
Beskrivelse og bildeoppdatering: 2019-09-07

Tafinlar er et antineoplastisk legemiddel, en proteinkinasehemmer.
Slipp form og komposisjon
Tafinlar produseres i form av kapsler: harde, ugjennomsiktige, inne i kapslene er det et pulver fra nesten hvitt til hvitt:
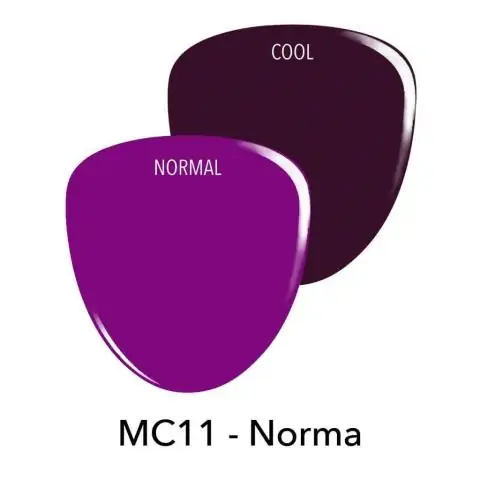
- dosering på 50 mg: størrelse nr. 2, mørkerød, GS TEW-inskripsjon på lokket med svart blekk, 50 mg på kroppen;
- dosering 75 mg: størrelse nr. 1, mørkrosa farge, påskriften GS LHF påføres lokket på lokket, 75 mg på kroppen.
Emballasje: 28 stk. eller 120 stk. i polyetylenflasker, i en pappeske 1 flaske og bruksanvisning for Tafinlar.
1 kapsel inneholder:
- virkestoff: mikronisert dabrafenibmesylat - 59,25 mg eller 88,88 mg, noe som tilsvarer innholdet på 50 mg eller 75 mg dabrafenib;
- hjelpekomponenter: mikrokrystallinsk cellulose, magnesiumstearat, kolloid silisiumdioksid;
- kapsel skall størrelse # 1: ugjennomsiktig rosa, hypromellose, titandioksid, rød jernoksid;
- kapsel skall størrelse # 2: svensk appelsin, hypromellose, titandioksid, rød jernoksid;
- S-1-17822 eller S-1-17823 blekk: shellak, propylenglykol, butanol, isopropanol, jernfargestoff svart oksid, vandig ammoniakk.
Farmakologiske egenskaper
Farmakodynamikk
Tafinlar er et antineoplastisk legemiddel. Den aktive ingrediensen, dabrafenib, er en potent selektiv hemmer av RAF-kinaser som konkurrerer med ATP (adenosintrifosforsyre).
Farmakodynamikk av dabrafenib i monoterapi
Når monoterapi med Tafinlar, den inhibitoriske konsentrasjon IC 50 (konsentrasjonen av halv-maksimal hemming) av Dabrafenib for isoenzymer er: BRAF V600E - 0,65 nmol / l; BRAF V600K - 0,5 nmol / l; BRAF V600D - 1,84 nmol / L.
Onkogene mutasjoner av BRAF-genet som koder for proteinet, forårsaker konstitutiv aktivering av RAS / RAF / MEK / ERK-banen og stimulering av tumorcellevekst. En høy frekvens av mutasjoner i BRAF-genet påvises i melanom (ca. 50% av tilfellene) og andre spesifikke svulster. Oftest har kreftpasienter en mutasjon i BRAF V600E og BRAF V600K genene, som utgjør 95% av BRAF genmutasjonene. Mutasjoner BRAF V600D, BRAF V600G og BRAF V600R er sjeldne. Den hemmende aktiviteten av Dabrafenib manifesterer seg mot villtype-Craf og BRAF isoenzymer, dets IC 50er henholdsvis 5 nmol / l og 3,2 nmol / l. Tafinlar hemmer veksten av ikke-småcellet lungekreftceller som bærer BRAF V600 -genmutasjonen in vitro og in vivo i xenograft-modeller av melanom.
Farmakodynamikk av dabrafenib i kombinasjon med trametinib
Trametinib er en svært selektiv, reversibel allosterisk inhibitor for aktivering av mitogenaktiverte kinaser 1 og 2 (MEK1 og MEK2), som reguleres ved ekstracellulær signalering. MEK-proteiner er komponenter i den ekstracellulære signal kinase (ERK) signalveien.
Bruk av Tafinlar i kombinasjon med trametinib forårsaker samtidig hemming av BRAF og MEK, to kinaser av denne signalveien. Dette gjør det mulig å oppnå duplisert undertrykkelse av proliferativ signaloverføring og additiv synergistisk effekt av legemidler i melanomcellelinjer, samt ikke-småcellet lungekreft med BRAF-mutasjon. I tillegg reduseres dannelsen av resistens i melanom-xenotransplantater som bærer BRAF V600 -genmutasjonen i kombinasjon med trametinib-terapi.
I følge resultatene av in vitro-studier og i dyreforsøk ble det avslørt at dabrafenib hemmer fosforylerte ERK-kinase (en underliggende farmakodynamisk markør) i melanomceller som bærer BRAF V600- mutasjonen. Hos pasienter med melanom, BRAF V600- mutasjonen, hemmer dabrafenib aktiviteten til fosforylert ERK-kinase i forhold til utgangsverdien.
Forlengelse av QT-intervallet
Spesialiserte studier er utført for å evaluere den potensielle effekten av gjentatt dabrafenib-administrasjon på forlengelse av QT-intervallet. 32 pasienter med svulster med en BRAF V600 -genmutasjon tok dabrafenib i en dose på 300 mg (overskred den terapeutiske dosen) to ganger daglig. Samtidig var det ingen klinisk signifikant effekt av dabrafenib eller dets metabolitter på forlengelse av QTc-intervallet - QT-intervallet korrigert i forhold til hjertefrekvensen (HR).
Hos 3% av pasientene som fikk dabrafenib, ble maksimalt QTc-intervall forlenget, mer enn 60 ms, observert, inkludert en episode med en økning på mer enn 500 ms fra totalindikasjonen i populasjonen.
I løpet av fase III-studien av MEK115306 hos pasienter som tok trametinib i kombinasjonsbehandling med dabrafenib, ble ikke et eneste tilfelle av forlengelse av QT-intervallet, korrigert med QTc (B) (Bazetts formel), registrert mer enn 500 ms. En utvidelse av QTc (B) over 60 ms fra baseline ble observert i mindre enn 1% av tilfellene (hos 3 pasienter av 209).
Når man studerte effekten av trametinib i kombinasjon med dabrafenib på pasienter med fase III MEK116513, hadde 4 (1%) QTc-forlengelse (B) av grad 3 - mer enn 500 ms, 2 (0,5%) hadde QTc-forlengelse (B) Grad 3 - mer enn 500 ms, som også var en forlengelse på mer enn 60 ms fra den første indikatoren.
Farmakokinetikk
Når det tas oralt, absorberes dabrafenib aktivt. Dens maksimale konsentrasjon (C max) i plasma oppnås i gjennomsnitt etter 2 timer. Den absolutte biotilgjengeligheten kan i gjennomsnitt være 95%. På bakgrunn av regelmessig bruk 2 ganger om dagen, er en økning i eksponeringen av AUC for dabrafenib (område under den farmakokinetiske kurven "konsentrasjon - tid") og, i mindre grad, C max avhengig av dosen som tas. Det antas at en viss reduksjon i eksponering ved gjentatt bruk kan skyldes induksjon av dets egen metabolisme. Det gjennomsnittlige AUC-kumulasjonsforholdet etter 18 dagers behandling var 0,73. Etter å ha tatt Tafinlar i en dose på 150 mg 2 ganger daglig, var det geometriske gjennomsnittet C max 1478 ng / ml, AUC 0 - τ- 4341 ng × time / ml, stoffets konsentrasjon før dosen (Cτ) - 26 ng / ml. Ved samtidig inntak av mat reduseres biotilgjengeligheten, absorpsjonen reduseres, reduseres med 51% C max og 31% AUC (sammenlignet med faste).
Plasmaproteinbinding er 99,7%, det tilsynelatende distribusjonsvolum (V d) er 70,3 liter.
In vitro er dabrafenib et substrat for humant P-glykoprotein (P-gp) og brystkreftresistensprotein (BCRP1). Når det administreres oralt, påvirkes biotilgjengeligheten og eliminasjonen av dabrafenib litt av disse vektorene, så risikoen for legemiddelinteraksjoner er minimal.
Dabrafenib metaboliseres i flere trinn. På første trinn, med deltagelse av CYP2C8- og CYP3A4-isoenzymer, dannes hydroksydabrafenib som oksyderes til karboksydabrafenib ved bruk av CYP3A4-isoenzymet. Karboksydabrafenib, som et resultat av ikke-enzymatisk dekarboksylering, blir biotransformert til desmetyldabrafenib, som oksyderes av CYP3A4-isoenzymet. Karboksydabrafenib skilles ut i galle og urin. Dannelse og reabsorpsjon av desmetyldabrafenib kan også forekomme i tarmen.
Den terminale halveringstiden (T 1/2) av hydroksydabrafenib er 10 timer, karboksydabrafenib og desmetyldabrafenib er fra 21 til 22 timer. Aktiviteten til hydroksydabrafenib og desmetyldabrafenib spiller en viktig rolle i realiseringen av den kliniske effekten av dabrafenib, karboksydabrafenibs rolle er ubetydelig.
I forbindelse med forlengelsen av terminalfasen er den endelige T 1/2 av dabrafenib 8 timer, klaring etter en gangs bruk er 17 l / t, etter 14 dagers inntak 2 ganger om dagen - 34,4 l / t. Dabrafenib utskilles hovedsakelig gjennom tarmene (71% av dosen som tas), gjennom nyrene - 23%.
Med en mild grad av leverdysfunksjon på grunn av oral administrering av dabrafenib, skiller klaring ikke seg vesentlig fra pasienter med normal leverfunksjon. I tillegg påvirker mild leverdysfunksjon ikke signifikant plasmakonsentrasjonen av dabrafenib-metabolitter. I tilfelle moderat til alvorlig leverfunksjon, bør Tafinlar brukes med forsiktighet.
Når legemidlet tas oralt, har mild til moderat nedsatt nyrefunksjon med kreatininclearance (CC) fra 30 til 89 ml / min en svak og klinisk ubetydelig effekt på clearance av dabrafenib, samt på plasmakonsentrasjonene av hydroksydabrafenib, karboksydabrafenib og desmetyldabrafenib. Tafinlars innflytelse på tilstanden til pasienter med alvorlig nedsatt nyrefunksjon er ikke fastslått.
Resultatene av populasjonsfarmakokinetisk analyse indikerer at det ikke er noen signifikant effekt av pasientens alder på farmakokinetikken til dabrafenib. Hos pasienter i alderen 75 år og eldre er det forventet høyere plasmakonsentrasjoner av karboksydabrafenib og desmetyldabrafenib (40% økning i eksponering). Sikkerheten og effekten av Tafinlar hos personer under 18 år er ikke fastslått.
Når det gis oralt, anses ikke effekten av pasientens kroppsvekt og kjønn på farmakokinetiske parametere som dabrafenib-clearance, distribusjonsvolum og distribusjonsklarering, klinisk signifikant.
Effekten av rase på farmakokinetikken til dabrafenib er ikke fastslått.
Som et resultat av kombinert gjentatt administrering av dabrafenib i en dose på 150 mg 2 ganger daglig og trametinib i en dose på 2 mg en gang daglig, øker C max for dabrafenib med 16% og AUC - med 23%. Biotilgjengeligheten av trametinib avtar noe, AUC blir 12% lavere. Disse endringene er ikke klinisk signifikante.
Indikasjoner for bruk
Bruk av Tafinlar er indisert ved behandling av følgende kreftformer forårsaket av en mutasjon i BRAF V600- genet:
- urettbar eller metastatisk melanom (monoterapi / kombinasjon med trametinib);
- adjuvant behandling etter total reseksjon av stadium III melanom (kombinasjon med trametinib);
- avansert ikke-småcellet lungekreft (monoterapi / kombinasjon med trametinib).
Kontraindikasjoner
Absolutt:
- melanom eller ikke-småcellet lungekreft med villtype BRAF-mutasjon;
- periode med graviditet;
- amming;
- alder opp til 18 år;
- overfølsomhet overfor stoffene i stoffet.
Det anbefales å bruke Tafinlar kapsler med forsiktighet ved behandling av pasienter med alvorlig nedsatt nyrefunksjon, moderat og alvorlig leverdysfunksjon, samtidig behandling med legemidler som er indusere eller hemmere av CYP3A4 og CYP2C8 isoenzymer eller substrater av polypeptidbærere av organiske anioner OATP1B1 og OATP1B3.
Tafinlar, bruksanvisning: metode og dosering
Tafinlar bør behandles av en lege med erfaring i bruk av antineoplastiske midler.
Kapsler tas oralt 1 time før måltider eller 2 timer etter måltider. Det bør observeres et intervall på 12 timer mellom hver dose. Hvis du ved et uhell hopper over å ta neste dose, kan du bare ta den glemte dosen hvis det er mer enn 6 timer før neste dose. Ved behandling med legemidlet i kombinasjon med trametinib, bør en enkelt daglig dose trametinib tas regelmessig samtidig som dabrafenib om morgenen eller kvelden.
Bruk av Tafinlar bør bare startes etter passende bekreftelse av BRAF V600 -genmutasjonen hos hver pasient ved en godkjent eller validert test.
Anbefalt dosering: monoterapi eller i kombinasjon med trametinib - 150 mg dabrafenib 2 ganger daglig (total daglig dose på 300 mg). Varigheten av behandlingen bestemmes av den kliniske effekten av Tafinlar.
Hvis en toksisk reaksjon eller andre bivirkninger oppstår, bortsett fra plateepitelcellens hudkreft (SCRC) eller et nytt fokus for primært melanom, kan det være nødvendig å redusere dosen, avbryte behandlingen eller fullføre behandlingen.
Når du reduserer den daglige dosen av dabrafenib, bør følgende ordning følges:
- startdose: 300 mg (150 mg 2 ganger / dag);
- reduksjon av første dose: 200 mg (100 mg 2 ganger / dag);
- andre dose reduksjon: 150 mg (75 mg 2 ganger / dag);
- tredje dose reduksjon: 100 mg (50 mg 2 ganger / dag).
En dosereduksjon på mindre enn 100 mg (50 mg 2 ganger / dag) anbefales ikke.
Behovet for dosejustering av Tafinlar bestemmes ved å vurdere alvorlighetsgraden av bivirkninger ved bruk av CTC-AE-skalaen (standardkriterier for vurdering av bivirkninger), versjon 4.
Anbefalt dosejusteringsregime for dabrafenib:
- ugunstige toksiske reaksjoner med alvorlighetsgrad på 1 eller 2 (tålelig): behandlingen fortsettes, pasientens tilstand overvåkes i samsvar med kliniske indikasjoner;
- ugunstige toksiske reaksjoner på 2 (uutholdelig) eller 3 alvorlighetsgrader: en pause i bruken av stoffet er indikert i perioden til bivirkningene tilsvarer 0-1 grader. Behandlingen bør gjenopptas med en dose redusert med 1 nivå;
- uønskede toksiske reaksjoner med 4 grad av alvorlighetsgrad: inntak av Tafinlar stoppes eller avbrytes i en periode til pasientens tilstand gjenoppretter, og vil tilsvare 0-1 grader av toksiske reaksjoner. Etter en tvungen pause begynner behandlingen med en dose redusert med 1 nivå.
Etter vellykket å overvinne det uønskede fenomenet, er en trinnvis økning i dosen mulig, som utføres i motsatt rekkefølge av reduksjonen i dosen.
Hvis bivirkninger som feber og uveitt oppstår under behandling med dabrafenib i kombinasjon med trametinib, bør passende tiltak tas:
- feber (en økning i kroppstemperatur over 38,5 ° C): hvis det dukker opp under monoterapi med Tafinlar eller behandling i kombinasjon med trametinib, bør legemidlet avbrytes, og behandlingen med trametinib bør fortsettes i samme dose. Pasienten får forskrevet antipyretika (ibuprofen, acetaminophen eller paracetamol) og undersøkes for tegn og symptomer på infeksjon. Etter normalisering av kroppstemperatur kan inntak av legemidlet i samme dose gjenopptas i kombinasjon med profylaktiske febernedsettende medisiner. Å redusere dosen av Tafinlar med ett nivå er indikert i tilfeller der utvikling av feber gjentas og / eller er ledsaget av slike alvorlige symptomer som dehydrering, arteriell hypotensjon, nyresvikt. Med ineffektivitet av febernedsettende middel, er utnevnelsen av orale glukokortikosteroider indikert;
- uveitt: Med utviklingen blir ikke Tafinlar-dosen justert hvis det er mulig å kontrollere symptomene på den inflammatoriske prosessen ved å bruke oftalmiske legemidler til lokal bruk. Inntak av kapsler er avbrutt i fravær av klinisk respons på den pågående behandlingen av uveitt i perioden med lindring av den inflammatoriske prosessen. Antineoplastisk behandling ble gjenopptatt med en redusert dose dabrafenib med ett nivå; ingen endring i trametinib-dosen var nødvendig.
Hvis det oppstår andre toksiske reaksjoner på bakgrunn av kombinasjonsbehandling med trametinib, gitt alvorlighetsgraden av pasientens tilstand, er det nødvendig å redusere dosen av to legemidler samtidig, avbryte eller fullstendig stoppe den kombinerte behandlingen.
For pasienter over 65 år, med mild til moderat nedsatt nyrefunksjon eller mild leverdysfunksjon, er dosejustering ikke nødvendig.
Spesiell forsiktighet bør utvises ved behandling av pasienter med alvorlig nedsatt nyrefunksjon og / eller moderat til alvorlig leverfunksjon.
Bivirkninger
Bivirkninger identifisert i en klinisk studie med 578 personer med melanom som tok Tafinlar som monoterapi i mer enn 6 måneder:
- svulster (inkludert cyster og polypper) av godartet, ondartet og uspesifisert karakter: veldig ofte - papillom; ofte - myk vorte (akrochordon), seborrheisk keratose, plateepitelkreft i huden, basalcellekreft; sjelden - dannelsen av et nytt fokus for primær melanom;
- fra immunforsvaret: sjelden - overfølsomhetsreaksjoner;
- smittsomme og parasittiske patologier: ofte - nasofaryngitt;
- fra metabolisme og ernæring: ofte - nedsatt appetitt; ofte - hyperglykemi, hypofosfatemi;
- fra nervesystemet: veldig ofte - hodepine;
- fra synsorganet: sjelden - uveitt;
- fra luftveiene, bryst og mediastinumorganer: veldig ofte - hoste;
- fra mage-tarmkanalen: veldig ofte - diaré, kvalme, oppkast; ofte forstoppelse; sjelden - pankreatitt;
- på den delen av huden og subkutant vev: veldig ofte - hudutslett, hyperkeratose, palmar-plantar erytrodysestesi, alopecia; ofte - tørr hud, kløe, erytem, hudlesjoner, lysfølsomhetsreaksjoner, aktinisk keratose; sjelden - pannikulitt;
- fra muskuloskeletalsystemet: veldig ofte - smerter i lemmer, artralgi, myalgi;
- fra urinsystemet: sjelden - nefritt, nyresvikt, akutt nyresvikt;
- generelle lidelser: veldig ofte - økt tretthet, feber, asteni, frysninger ofte - influensalignende syndrom.
Bivirkninger etablert i en klinisk studie med 1076 pasienter (hvorav 82 pasienter med avansert ikke-småcellet lungekreft), som tok Tafinlar som kombinasjonsbehandling med trametinib:
- infeksjoner og invasjoner: veldig ofte - nasofaryngitt; ofte - urinveisinfeksjon, follikulitt, cellulitt, pustulært utslett, paronychia;
- svulster (inkludert cyster og polypper) av godartet, ondartet og uspesifisert karakter: ofte - plateepitelcancer hudkreft (inkludert Bowens sykdom / dermatose, keratoacanthoma), papilloma (inkludert hud papilloma), seborrheisk keratose; sjelden - akrochordon, et nytt fokus for primær melanom (inkludert ondartet melanom, metastatisk ondartet melanom, overfladisk spredning av stadium III melanom);
- fra huden og subkutant vev: veldig ofte - kløe, utslett, tørr hud, erytem; ofte - aktinisk keratose, akneform dermatitt, nattesvette, alopecia, palmar-plantar erytrodysestesisyndrom, hyperkeratose, hudlesjoner, pannikulitt, hyperhidrose, lysfølsomhetsreaksjoner, overfladiske sprekker i huden;
- fra den delen av blodet og lymfesystemet: ofte - nøytropeni, leukopeni, anemi, trombocytopeni;
- fra immunforsvaret: sjelden - overfølsomhetsreaksjoner;
- fra metabolisme og ernæring: ofte - nedsatt appetitt; ofte - hyponatremi, hyperglykemi, hypofosfatemi, dehydrering;
- fra nervesystemet: veldig ofte - svimmelhet, hodepine;
- fra synsorganet: ofte - synshemming, uveitt, tåkesyn; sjelden - retinal løsrivelse, korioretinopati, periorbital ødem;
- fra siden av hjertet: ofte - en reduksjon i utkastningsfraksjonen; sjelden - bradykardi; frekvens ikke etablert - myokarditt;
- på vaskulær side: veldig ofte - blødninger av forskjellig lokalisering (inkludert intrakraniell blødning, dødelig blødning), arteriell hypertensjon; ofte - lymfødem, arteriell hypotensjon;
- fra luftveiene, brystet og mediastinum: veldig ofte - hoste; ofte - kortpustethet; sjelden - lungebetennelse;
- fra mage-tarmkanalen: veldig ofte - forstoppelse, diaré, smerter i øvre og nedre del av magen, kvalme, oppkast; ofte - stomatitt, tørr munn; sjelden - kolitt, pankreatitt; sjelden - perforering av mage-tarmkanalen;
- fra muskuloskeletalsystemet: veldig ofte - smerter i lemmer, muskelspasmer, muskelstivhet, artralgi, myalgi;
- fra urinveiene: sjelden - nefritt, nyresvikt;
- generelle lidelser: veldig ofte - frysninger, feber, økt tretthet, asteni, perifert ødem, influensalignende patologier; ofte - hevelse i ansiktet, betennelse i slimhinner;
- laboratorieindikatorer: veldig ofte - en økning i aktiviteten til alaninaminotransferase, aspartataminotransferase; ofte - en økning i aktiviteten til gamma-glutamyltransferase, alkalisk fosfatase, kreatinfosfokinase.
Overdose
Til dags dato er data om overdosering av dabrafenib begrenset. Maksimal dose som pasienter mottok i kliniske studier er 600 mg (300 mg 2 ganger / dag). Overdoseringssymptomer er ikke fastslått.
Behandling: det er ingen spesifikk motgift. I tilfelle utvikling av bivirkninger foreskrives symptomatisk og støttende behandling, tilsvarende de kliniske manifestasjonene. Umiddelbar uttak av stoffet er nødvendig.
spesielle instruksjoner
Før du begynner å bruke stoffet Tafinlar i kombinasjon med trametinib, bør du også lese de fullstendige instruksjonene for medisinsk bruk av sistnevnte.
På bakgrunn av monoterapi med Tafinlar eller i kombinasjon med trametinib, kan feber og alvorlig ikke-smittsom feberfeber forekomme. De vanligste tilfellene av feber ble observert under behandling av urettbar eller metastatisk melanom hos pasienter som fikk Tafinlar i kombinasjon med trametinib. De første episodene av feber opptrer vanligvis i begynnelsen av behandlingen (den første måneden), og kan være ledsaget av alvorlige tremor, arteriell hypotensjon, dehydrering og i sjeldne tilfeller - utvikling av akutt nyresvikt. Hos pasienter som har opplevd alvorlige feberepisoder, bør nyrefunksjonsparametere, inkludert serumkreatininkonsentrasjon, overvåkes. For å lindre disse tilstandene, anbefales det å justere dosen av dabrafenib og / eller å avbryte behandlingen mens du foreskriver vedlikeholdsbehandling.
Sannsynligheten for å utvikle plateepitelhudkreft (SCRC) hos pasienter med uretabel eller metastatisk melanom er høyere når legemidlet brukes som monoterapi. I løpet av kliniske studier ble det funnet at etter starten av monoterapi med Tafinlar, kan de første tegn på SCRC dukke opp etter 2 måneder og bli notert hos 10% av pasientene. Mens i kombinasjonsbehandling med trametinib, SCRC bare observeres hos 3% av pasientene, og perioden før de første tegnenes utseende er 5-8 måneder. Ved behandling av ikke-småcellet lungekreft ble SCRC observert hos 18% av pasientene som fikk monoterapi med legemidlet, og hos 2% av pasientene som fikk dabrafenib i kombinasjon med trametinib. Da SCRC dukket opp på bakgrunn av stoffbruken, ble behandlingen hos mer enn 90% av pasientene fortsatt uten å endre dosen.
Hudens tilstand bør undersøkes både før behandlingsstart og regelmessig i løpet av behandlingen med et intervall på 2 måneder. Det er nødvendig å fortsette å overvåke tilstanden til huden etter avsluttet medisinering med et intervall på 2-3 måneder de neste 6 månedene. En diagnostisert SCRC krever kirurgi på det berørte området uten å stoppe behandlingen med dabrafenib. Pasienten bør informeres om behovet for å kontakte den behandlende legen umiddelbart hvis det oppstår nye lesjoner på huden.
På grunn av den eksisterende risikoen for å utvikle ondartede svulster fra annen lokalisering som bærer RAS-genmutasjonen, bør pasienten gis passende observasjon i løpet av Tafinlar-perioden og innen 6 måneder etter kanselleringen. Når ondartede svulster med en annen lokalisering dukker opp, avgjøres spørsmålet om å fortsette behandlingen med stoffet individuelt.
I tilfelle magesmerter av ukjent etiologi, er det nødvendig å gjennomføre en undersøkelse for å bestemme aktiviteten til amylase og lipase i blodserumet. Hvis utviklingen av pankreatitt bekreftes, bør behandlingen avbrytes, og pasienten bør følges nøye etter at behandlingen med dabrafenib er gjenopptatt.
Før du begynner å bruke Tafinlar, etter en måneds behandling og ved hver dosejustering, er det nødvendig å gjennomføre en elektrokardiografisk studie (EKG) og bestemme innholdet av elektrolytter i plasma (inkludert magnesium). Det anbefales ikke å ta Tafinlar i tilfelle korreksjon av ubalanse i vann og elektrolyttbalanse, forlengelse av QT-intervalsyndromet og pasienter som tar medisiner som kan forårsake forlengelse av QT-intervallet. Dabrafenib skal ikke initieres eller fortsettes med et QTc-intervall på mer enn 500 ms. Behandlingen kan gjenopptas med redusert dose hvis QTc-verdien er mindre enn 500 ms, oppnådd etter gjenoppretting av vannelektrolyttbalansen og korreksjon av hjertefaktorer som påvirker forlengelsen av QT-intervallet (inkludert kongestiv hjertesvikt og bradykardi). Behandling med legemidlet bør avbrytes helt når QTc-intervallet er mer enn 500 ms, samt i tilfelle en økning fra den opprinnelige verdien på mer enn 60 ms.
Ved forskrivning av Tafinlar, bør pasienter informeres om behovet for øyeblikkelig legehjelp i tilfelle symptomer på bivirkninger.
Personer med allerede diagnostisert hyperglykemi eller diabetes mellitus bør advares om behovet for nøye å overvåke konsentrasjonen av glukose i blodserumet, og umiddelbart oppsøke lege i tilfelle overdreven tørst, økt volum og hyppighet av vannlating. Resultatene fra laboratoriestudier indikerer at forekomsten av grad 3 hyperglykemi ved bruk av dabrafenib er 6%.
Det anbefales å bruke Tafinlar med forsiktighet og under nøye medisinsk tilsyn hos pasienter med mangel på glukose-6-fosfatdehydrogenase. Dette er assosiert med økt risiko for å utvikle hemolytisk anemi hos denne pasientkategorien, ledsaget av generell svakhet, tretthet, muskelkramper og kortpustethet.
Innflytelse på evnen til å kjøre biler og komplekse mekanismer
I løpet av behandlingsperioden med Tafinlar bestemmes pasientens evne til å kjøre bil og utføre annet arbeid som krever høy hastighet av psykomotoriske reaksjoner individuelt, med tanke på pasientens generelle tilstand og stoffets toksisitetsprofil.
Påføring under graviditet og amming
Bruk av Tafinlar er kontraindisert under svangerskap og amming.
I løpet av vitenskapelige studier av effekten av stoffet på fosterutvikling hos dyr, viste dabrafenib embryotoksisk og teratogen effekt. Etter å ha nådd en eksponering som overstiger 0,5 ganger den maksimale anbefalte dosen på 150 mg 2 ganger / dag ved fødselen til mennesker, viste avkomene et forsinket skjelettutvikling og en reduksjon i kroppsvekt. I tilfelle eksponering som overstiger det når man bruker den maksimale anbefalte dosen til mennesker tre ganger, ble fosteret i tillegg observert å ha mangler i det interventricular septum, variasjoner i form av tymus og embryoletalitet. Legen må nødvendigvis informere den gravide pasienten om den mulige risikoen for fostrets utvikling.
Det er ingen pålitelige data om effekten av dabrafenib på ammende babyer, samt melkeproduksjonen under amming. Risikoen for en negativ effekt av Tafinlar på barn som får morsmelk kan ikke utelukkes. I denne forbindelse er det nødvendig å advare ammende kvinner om potensielle risikoer for babyen. Når du forskriver legemidlet under amming, bør fordelene ved amming for barnet og viktigheten av terapi for moren vurderes nøye. Hvis sistnevnte råder, stoppes amming.
Pasienter i reproduksjonsalderen rådes til å bruke pålitelige prevensjonsmetoder under hele behandlingsperioden og i minst 4 måneder etter at den er avsluttet. Bruken av hormonell prevensjon samtidig som dabrafenib er ineffektiv.
Barndomsbruk
Det er kontraindisert å foreskrive Tafinlar kapsler for behandling av barn og ungdom på grunn av manglende data om sikkerhet og effekt av legemidlet under 18 år.
Med nedsatt nyrefunksjon
Tafinlar bør brukes med forsiktighet ved alvorlig nedsatt nyrefunksjon.
Ingen dosejustering er nødvendig for mild til moderat nedsatt nyrefunksjon.
Spesiell forsiktighet bør utvises ved behandling av pasienter med alvorlig nedsatt nyrefunksjon.
For brudd på leverfunksjonen
Tafinlar bør brukes med forsiktighet ved moderat og alvorlig leverfunksjon.
Ved mild leverdysfunksjon er dosejustering ikke nødvendig.
Ta kapsler med ekstrem forsiktighet ved moderat til alvorlig leverfunksjon.
Bruk hos eldre
Dosejustering av Dabrafenib er ikke nødvendig for pasienter over 65 år.
Narkotikahandel
Med samtidig bruk av Tafinlar:
- ketokonazol, gemfibrozil, ritonavir, sakinavir, nefazodon, klaritromycin, telitromycin, itrakonazol, atazanavir, vorikonazol, posakonazol og andre legemidler som er sterke hemmere av CYP2C8 og CYP3A4-enzymer: disse legemidlene kan forårsake en økning i konsentrasjonen;
- rifampicin, fenytoin, karbamazepin, fenobarbital, johannesurtpreparater (indusere av CYP2C8 eller CYP3A4 isoenzymer): kombinert bruk fører til en reduksjon i nivået av dabrafenib i blodet;
- OATP1B1 og OATP1B3 substrater, inkludert rosuvastatin: en mulig økning i C max og AUC for OATP1B1 og OATP1B3 substrater med en smal terapeutisk indeks bør tas i betraktning;
- rabeprazol og andre legemidler som øker surheten i magesaft: forårsaker ikke klinisk signifikante forstyrrelser i farmakokinetikken til dabrafenib;
- medikamenter som er følsomme for induksjon av CYP3A4- eller CYP2C9-isoenzymer (inkludert warfarin, deksametason, hormonelle prevensjonsmidler): konsentrasjonen kan reduseres og tap av klinisk effekt, derfor bør det utvises forsiktighet hvis samtidig behandling med slike legemidler er nødvendig eller alternativ behandling bør foreskrives.
I tillegg forventes interaksjonen mellom dabrafenib og dets metabolitter med følgende legemidler, men intensiteten kan ha signifikante forskjeller: fentanyl, metadon og andre smertestillende midler; klaritromycin, doksycyklin og andre antibiotika; antineoplastiske midler inkludert cabazitaxel; antikoagulantia, inkludert acenokumarol, warfarin; antiepileptika, inkludert karbamazepin, valproinsyre, fenytoin, primidon; antipsykotika som haloperidol; kalsiumkanalblokkere som diltiazem, nikardipin, nifedipin, felodipin, verapamil; deksametason, metylprednisolon og andre kortikosteroider; kardiale glykosider slik som digoksin; antivirale midler for behandling av HIV (human immunsviktvirus) infeksjon, inkludert amprenavir, atazanavir, delavirdin, efavirenz, darunavir, fosamprenavir,indinavir, saquinavir, tipranavir, lopinavir, nelfinavir; diazepam, zolpidem, midazolam og andre hypnotika; atorvastatin, simvastatin og andre statiner metabolisert av CYP3A4; immunsuppressiva inkludert takrolimus, sirolimus, syklosporin.
Ved kombinert behandling med Tafinlar og trametinib er det også nødvendig å ta hensyn til interaksjonen mellom trametinib og andre legemidler som brukes samtidig.
Analoger
Analogen til Tafinlar er Ervoy, Mekinist, Zelboraf, Keytruda, Opdivo, Rafinlar, etc.
Vilkår for lagring
Oppbevares utilgjengelig for barn.
Oppbevares ved temperaturer opp til 30 ° C.
Holdbarhet er 2 år.
Vilkår for utlevering fra apotek
Reseptert på resept.
Anmeldelser om Tafinlar
Ifølge eksperter er Tafinlar et lovende medikament for målrettet (målrettet) terapi i et adjuverende miljø for melanom forårsaket av en mutasjon i BRAF V600- genet. Siden denne typen mutasjon forekommer hos omtrent halvparten av melanompasienter, er forbedring av progresjonsfri overlevelse og total overlevelse med medisinering veldig viktig.
Siden 2016 har Tafinlar, sammen med Mekinist, vært inkludert i behandlingsprotokollen for stadium III og IV melanom.
Kombinert målrettet adjuvant terapi med dabrafenib og trametinib dobler tilbakefallsfri overlevelse, ifølge COMBI-AD-studien presentert i Madrid på ESMO 2017 og publisert i den mest leste, siterte og innflytelsesrike tidsskriftet i allmennmedisin, New England Journal of Medicine. hos pasienter med stadium III BRAF mutant melanom.
Pasienter og deres pårørende bemerker også at bruk av Tafinlar gir en positiv trend i reduksjon og ødeleggelse av metastaser.
Pris for Tafinlar på apotek
Prisen på Tafinlar for en pakke som inneholder 120 kapsler, i en dose på 50 mg, kan variere fra 251 tusen rubler, i en dose på 75 mg - fra 268 tusen rubler.

Anna Kozlova Medisinsk journalist Om forfatteren
Utdanning: Rostov State Medical University, spesialitet "Allmennmedisin".
Informasjon om stoffet er generalisert, kun gitt for informasjonsformål og erstatter ikke de offisielle instruksjonene. Selvmedisinering er helsefarlig!